Perbandingan Kaedah Pengimejan 3D dalam Mikroskopi Elektron untuk Biobahan
BERITA JEOL Jld.53 No.8
Tomohiro Haruta
Jabatan Pengurusan Aplikasi, JEOL Ltd.
Tomografi TEM telah digunakan secara meluas untuk analisis tiga dimensi (3D) struktur halus. Baru-baru ini, kaedah analisis struktur 3D baharu dengan SEM, FIB-SEM, SEM Block-Face Bersiri (SBF-SEM) dan tomografi Tatasusunan, difokuskan oleh ramai penyelidik disebabkan peningkatan prestasi komputer dan SEM. Kaedah ini sesuai untuk sampel biologi kerana kawasan yang boleh diperhatikan adalah sangat luas berbanding dengan tomografi TEM. Setiap kaedah mempunyai kelebihan dan kekurangannya sendiri, namun, terdapat sedikit contoh perbandingan antara kaedah ini menggunakan sampel yang sama. Dalam kajian ini, kami membina semula struktur 3D sampel yang sama (E.coli dan phages) dengan kaedah FIB-SEM, SBF-SEM, Tatasusunan tomografi dan tomografi TEM, dan menyiasat kelebihan dan kekurangan kaedah ini.
Pengenalan
Adalah penting untuk mengetahui struktur 3D dan penyetempatan organel dan kompleks protein yang merupakan komponen sel untuk memahami fungsi sel dan tisu. Maklumat ini memainkan peranan penting bukan sahaja dalam penyelidikan akademik tetapi juga dalam pembangunan terapi untuk penyakit maut. Sebelum ini, tomografi TEM telah digunakan untuk pemerhatian struktur 3D bagi struktur nano ini. Dalam tomografi TEM, kami mengambil mikrograf imej condong bersiri, dan membina semula imej 3D dengan unjuran belakang siri imej yang diperolehi. Tomografi TEM menyediakan imej 3D resolusi tinggi, dan juga mempunyai had ketebalan yang ditentukan oleh penghantaran pancaran elektron. Oleh itu, sukar untuk memerhatikan imej 3D keseluruhan sel atau tisu oleh tomografi TEM. Histologi atau biologi sel terkini berkait rapat dengan biologi molekul, dan oleh itu adalah penting untuk mendedahkan pengaruh morfologi dan pengedaran struktur nano pada tisu dan keseluruhan sel. Atas sebab itu, kaedah mikroskopik baharu telah dibangunkan, yang membolehkan kita memerhatikan kawasan yang luas di mana keseluruhan sel atau tisu dikenali, dan boleh mengekalkan resolusi tinggi sambil mengenali kompleks organel dan protein. Dalam kajian ini, kami memberi tumpuan kepada tiga jenis kaedah pemerhatian 3D baharu, FIB-SEM, SBF-SEM dan tomografi Tatasusunan [1, 2, 3] (Rajah 1).
Rajah.1 Gambar rajah skema kaedah pembinaan semula 3D.
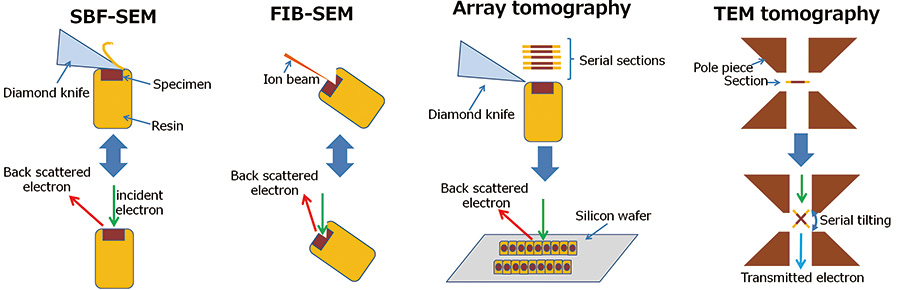
- SBF-SEM:
SBF-SEM mengulangi pemotongan sampel dengan pisau berlian dan pemerhatian imej elektron berselerak belakang permukaan sampel baharu dalam ruang spesimen. - FIB-SEM:
FIB-SEM mengulangi percikan sampel oleh pancaran ion galium terfokus dan pemerhatian imej elektron berselerak belakang permukaan sampel baharu dalam ruang spesimen. - Tomografi tatasusunan:
Bahagian bersiri disediakan dengan ultramikrotom dan dipasang pada substrat keras seperti wafer silikon. Bahagian bersiri ini diambil untuk imej elektron berselerak belakang satu demi satu dan disusun mengikut urutan. - Tomografi TEM:
Tomografi TEM mengambil imej unjuran condong bersiri oleh TEM, dan membina semula struktur 3D dalaman dengan unjuran belakang imej ini.
FIB-SEM ialah SEM yang dilengkapi dengan lajur pancaran ion terfokus (FIB). Satu sampel dalam kebuk spesimen terpercik oleh FIB, dan permukaan terpercik boleh diperhatikan oleh SEM. FIB tidak popular dalam biologi tetapi popular dalam sains bahan. Ini kerana spesimen dalam sains bahan (logam, seramik, dsb.) terlalu sukar untuk dihiris dengan pisau berlian, tetapi boleh dibuat menjadi bahagian nipis atau permukaan baharu terdedah dengan terpercik dengan FIB. Untuk memerhati struktur 3D dengan FIB-SEM, kami memercikkan permukaan spesimen, dan memerhati permukaan terdedah baharu dengan pengimejan elektron berselerak belakang dengan SEM, dan mengulangi proses sputtering dan pemerhatian. Akhir sekali, kita boleh membina semula struktur 3D dengan menyusun imej siri bahagian bersiri [1]. Kelebihan FIB-SEM ialah penentuan ketepatan tinggi tapak sputtering dan penyediaan bahagian nipis daripada sampel keras seperti tulang dan logam. Sebaliknya, kelemahannya ialah kawasan cerapan yang sempit dan kelajuan sputtering yang perlahan.
Dalam SBF-SEM, kami menggunakan SEM yang mempunyai mekanisme untuk memotong sampel dengan pisau berlian di dalam ruang spesimennya. Untuk membina semula imej 3D, permukaan sampel dihiris oleh pisau berlian di dalam ruang spesimen, dan permukaan terdedah baharu diperhatikan oleh SEM. Imej 3D dibina semula dengan menyusun imej siri bahagian bersiri seperti FIB-SEM [2]. Kelebihan SBF-SEM ialah kelajuan pemotongan tinggi dan kawasan pemotongan yang luas, kerana sampel dipotong oleh pisau berlian. Sebaliknya, terdapat kelemahan bahawa SBF-SEM memerlukan penyediaan sampel khas (cth kaedah NCMIR) kerana sampel perlu disediakan dengan kekonduksian elektron yang tinggi dan pewarnaan logam berat yang kuat [3]. Kualiti pengawet struktur nano oleh penyediaan sampel khas ini adalah lebih buruk daripada penyediaan konvensional untuk TEM. Walaupun kekonduksian sampel meningkat dengan penyediaan sampel khas, kadangkala sampel mungkin dicas.
Dalam tomografi Tatasusunan, mula-mula kita sediakan spesimen reben bahagian ultra-nipis oleh ultramikrotom, dan bahagian bersiri dipasang pada wafer konduktif seperti wafer silikon. Bahagian bersiri ini diperhatikan sekeping demi sekeping dengan SEM, dan imej 3D dibina semula untuk menyusun imej mengikut susunan [4]. Kelebihan kaedah ini adalah seperti berikut; Penindasan pengecasan sampel yang sangat nipis dan dipasang pada wafer konduktif, Kos permulaan yang rendah kerana kaedah ini hanya memerlukan SEM konvensional dan ultramikrotom, dan kita boleh menggunakan sampel yang baik yang disediakan oleh teknik penyediaan konvensional untuk TEM. Kelemahan kaedah ini ialah banyak usaha manual diperlukan, contohnya, penyediaan siri bahagian bersiri.
Terdapat sedikit perbincangan untuk membandingkan ciri dan spesifikasi ketiga-tiga kaedah ini, kerana prinsip kaedah pembinaan semula 3D ini dengan SEM adalah hampir sama. Iaitu, ketiga-tiga kaedah tersebut membolehkan kami membuat bahagian bersiri dan memerhati bahagian baharu. Dalam kajian ini, kami memerhati struktur 3D sampel yang sama dengan kaedah ini, dan membandingkan hasilnya. Akhir sekali, kami membincangkan dan meringkaskan ciri-ciri kaedah ini dan sampel dan analisis yang sesuai. Tambahan pula, kami cuba menganalisis beberapa sampel menggunakan kaedah yang sesuai.
Bahan dan Kaedah
Kami menggunakan E.coli dijangkiti oleh T4 phage, λ phage, dan φ174 phage sebagai sampel. Phages adalah sejenis virus yang menjangkiti bakteria. Saiznya ialah 200 nm atau kurang, dan adalah mustahil untuk memerhati morfologi mereka tanpa menggunakan mikroskop elektron (Rajah 2 ac).
Fag menyuntik genom mereka seperti DNA atau RNA ke dalam E.coli apabila phages melekat pada E.coli. Fag yang dijangkiti mengambil alih sistem transkripsi, sistem terjemahan, dan sistem replikasi sel perumah, dan membiak sendiri dalam sel perumah. Pada peringkat ini, kita boleh memerhatikan phage yang membiak masuk E.coli (Gamb. 2 df). Apabila fag membiak dengan cukup dalam perumah, fag pecah dan keluar dari sel perumah. Fag baru yang membiak melekat dan menjangkiti sel perumah baharu.
Mula-mula, kami timbunkan agar-agar LB lembut yang mengandungi E.coli pada agar LB keras. Phages telah dijangkiti E.coli dengan menjatuhkan larutan yang mengandungi fag ke atas agar-agar ini. Kami dapat mengenali kawasan di mana phages dijangkiti E.coli , sebagai plak selepas pengeraman agar ini, dan memperoleh fag yang dijangkiti E.coli dengan mengeluarkan plak ini.
Untuk tomografi TEM dan tomografi Tatasusunan, sampel telah diawalikan oleh 2.5% glutaraldehid dalam 0.1 M natrium cacodylate (pH 7.2), dan postfixed 1% OsO4 dalam 0.1 M natrium cacodylate (pH 7.2). Sampel tetap telah dibenamkan dalam resin epoksi. Sampel telah dihiris oleh ultramikrotome kepada bahagian nipis yang dipasang pada wafer silikon untuk tomografi Array. Bahagian nipis ini diwarnai oleh uranium asetat dan plumbum sitrat.
Untuk FIB-SEM dan SBF-SEM, kami menggunakan kaedah NCMIR untuk kesan logam berat yang kuat [3]. FIB-SEM juga boleh menggunakan sampel yang disediakan dengan kaedah konvensional, dan dalam kajian ini kami menggunakan kaedah NCMIR untuk mendapatkan imej kontras yang kuat. Selepas penetapan dan pewarnaan, sampel dibenamkan dalam resin epoksi. Keadaan cerapan ditunjukkan dalam Jadual 1.
Imej bahagian bersiri yang diperolehi oleh FIB-SEM, SBF-SEM dan tomografi Array telah diselaraskan oleh Fiji [5], dan imej 3D telah dibina semula oleh penumpuk (System In Frontier Inc. Japan). Dalam tomografi TEM, TEMography digunakan untuk pemerolehan imej condong bersiri dan pembinaan semula 3D. Imej 3D yang diperoleh telah dibahagikan dan dianalisis oleh Colorist (System In Frontier Inc. Japan).
Rajah.2 Imej TEM bagi faj.
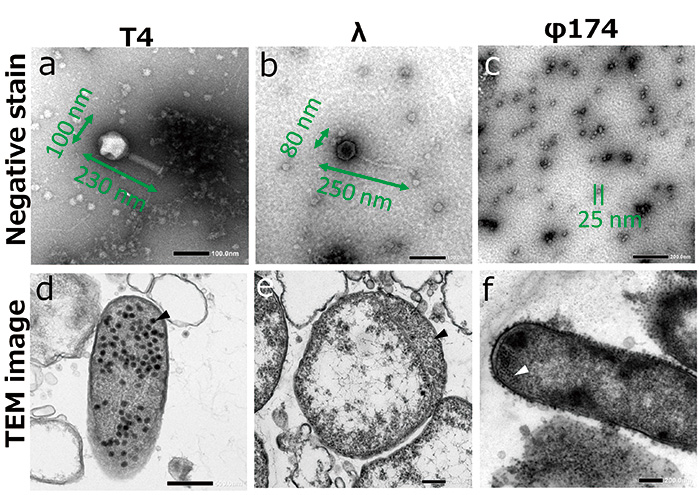
Imej phage (ac) bernoda negatif dan membiak dalam E.coli (df, kepala anak panah).
Jadual 1 Keadaan cerapan kaedah cerapan 3D.
| SBF-SEM | FIB-SEM | Tomografi tatasusunan | Tomografi TEM | |
|---|---|---|---|---|
| Alat | JSM-7800F dengan Gatan 3View 2XP | JIB-4610F | JSM-7800F | JEM-1400Plus |
| Kawasan pemerolehan (X,Y) | 24 × 24 μm2 | 18 × 24 μm2 | 19 × 24 μm2 | 3.5 × 3.5 μm2 |
| Kedalaman pemerolehan (Z) | 7.5 μm (50 nm × 150 imej) | 10.8 μm (20 nm × 543 imej) | 1.4 μm (70 nm × 20 imej) | 200 nm |
| Saiz piksel (X,Y) | 3 nm | 9.4 nm | 4.7 nm | 1.72 nm |
| Saiz piksel (Z) | 50 nm | 20 nm | 70 nm | 1.72 nm |
| Bilangan piksel | × 8192 8192 | × 1920 2560 | × 3840 5120 | × 2048 2048 |
| Mempercepatkan voltan | 1.0 kV | 3.0 kV | 7.0 kV | 120 kV |
| Masa perolehan | 2.5 jam | 48 jam | 4 jam | 1 jam |
Hasil dan Perbincangan
Perbandingan kaedah pembinaan semula 3D menggunakan mikroskop elektron
Kami memerhati imej 2D menggunakan FIB-SEM, SBF-SEM (imej elektron berselerak belakang permukaan sampel pukal, voltan pecutan masing-masing adalah 1.0 kV dan 3.0 kV), Tomografi tatasusunan (imej elektron berselerak belakang sampel bahagian nipis yang dipasang pada wafer silikon, voltan pecutan ialah 7.0 kV), dan tomografi TEM (imej unjuran sampel bahagian nipis, tiada senget, voltan pecutan ialah 120 kV). FIB-SEM dan SBF-SEM untuk pemerhatian permukaan sampel pukal adalah lebih rendah daripada tomografi Tatasusunan dan tomografi TEM untuk pemerhatian bahagian nipis dalam ketajaman imej (Rajah 3). Ini kerana, dalam sampel ini, kebanyakan kawasan cerapan hanya diisi dengan resin kekonduksian rendah dan kami terpaksa memerhati dengan voltan pecutan rendah untuk menekan pengecasan. Kualiti imej tomografi Array adalah sama dengan tomografi TEM. Keputusan ini mencadangkan bahawa peningkatan kekonduksian sampel dan pemerhatian pada voltan pecutan tinggi adalah faktor penting untuk memerhati sampel biologi dalam pemerhatian struktur 3D dengan SEM (Rajah 3 c). Di samping itu, kualiti imej FIB-SEM dan SBF-SEM adalah rendah berbanding dengan dua kaedah lain, tetapi mereka mengekalkan resolusi untuk mengenali zarah faj.
Seterusnya, kami membandingkan hasil pembinaan semula 3D. Dalam tomografi TEM, ketebalan kepingan (200 nm) adalah lebih kecil daripada diameter E.coli (kira-kira 2 μm), supaya keseluruhan imej satu E.coli tidak boleh dibina semula menjadi 3D (Rajah 4 d). Sebaliknya, SBF-SEM dan FIB-SEM berjaya dalam pemerhatian 3D bagi volum yang besar (Rajah 4 a, b). Dalam tomografi Array, kawasan cerapan satah XY adalah setanding dengan kaedah SBF dan FIB-SEM. Walau bagaimanapun, ketebalan isipadu cerapan telah dikurangkan kerana kepingan yang disediakan hanya 20 dalam kajian ini (Rajah 4 c). Walaupun kemahiran matang dan masa pemerolehan yang panjang diperlukan, kami menganggap bahawa adalah mungkin untuk meningkatkan ketebalan imej pembinaan semula 3D dengan menyediakan bahagian bersiri jisim dan meningkatkan bilangan mikrograf yang diambil. Dalam hasil pengekstrakan satu E.coli dan pembahagian phages yang terkandung dalam E.coli dan membran ekstraselular E.coli , kita dapat mengenali morfologi bagi E.coli dan pengedaran 3D phages menggunakan sebarang kaedah, walaupun terdapat perbezaan dalam resolusi spatial (Rajah 4 eh). Memfokuskan pada satu zarah faj, bentuk faj dilanjutkan ke arah Z dalam tomografi SBF-SEM dan Array, kerana resolusi sepanjang Z tidak mencukupi terhadap saiz faj (Rajah 4 i, k). Dalam FIB-SEM, walaupun faj telah dibina semula sebagai bentuk bola, bagaimanapun, butiran imej pembinaan semula 3D hilang berbanding dengan hasil tomografi TEM (Rajah 4 j, l). Dengan mengambil kira hasil perbandingan, didapati analisis kuantitatif morfologi bagi E.coli dan analisis pengedaran phages dalam E.coli boleh dilakukan oleh mana-mana kaedah pembinaan semula 3D dengan SEM, sementara itu, tomografi TEM menyediakan resolusi spatial tinggi yang diperlukan untuk memerhatikan struktur nano seperti phages. Keputusan yang sangat serupa diperolehi dengan SBF-SEM dan FIB-SEM, yang mempunyai asas biasa untuk menghiris dan memerhati sampel pukal dalam ruang spesimen mereka. Jumlah yang hampir sama diperolehi oleh SBF-SEM dan FIB-SEM dalam kajian ini, dan masa pemerolehan SBF-SEM (2.5 jam) adalah kira-kira 20 kali lebih cepat daripada yang diperolehi oleh FIB-SEM (48 jam) (Jadual 1). ). Walau bagaimanapun, FIB-SEM menyediakan imej struktur 3D yang dibina semula dengan resolusi Z yang lebih tinggi daripada SBF-SEM. Perbezaan resolusi ini adalah disebabkan oleh perbezaan ketebalan pemotongan: 20 nm untuk FIB-SEM dan 50 nm untuk SBF-SEM.
Keputusan ini diringkaskan dalam Jadual 2. Kualiti imej SBF-SEM adalah lebih rendah daripada kaedah lain, namun julat luas kawasan cerapan dan kelajuan cerapan tidak dapat ditandingi dengan SBF-SEM. Tambahan pula, dalam sampel dengan kekonduksian tinggi, kualiti imej akan dipertingkatkan kerana voltan pecutan boleh dinaikkan lebih banyak. Untuk ciri di atas, SBF-SEM sesuai untuk sampel yang sangat besar dengan kekonduksian tinggi dan untuk analisis komprehensif. Sebagai contoh, sampel tisu adalah besar, kawasan resin adalah kecil, dan kekonduksian adalah tinggi. Analisis komprehensif diperlukan dalam analisis connectome.
FIB-SEM memerlukan masa pemerolehan yang lama berbanding dengan SBF-SEM, bagaimanapun, ia adalah berfaedah untuk FIB-SEM bahawa resolusi Z adalah sangat tinggi. Kelebihan ini hanya sah untuk kawasan cerapan yang sempit. FIB-SEM sesuai untuk sampel kecil, contohnya, tisu kecil atau satu sel keseluruhan. FIB-SEM mempunyai pertalian tinggi untuk analisis kuantitatif, kerana kuantitatif tinggi memerlukan resolusi tinggi. Di samping itu, adalah mungkin untuk memotong tulang dan logam, membolehkan analisis 3D tisu keras dan bahagian sentuhan antara logam dan tisu.
Dalam tomografi Array, sampel kekal selepas pemerhatian; Sementara itu, teknik matang yang membuat bahagian bersiri dan masa pemerolehan yang panjang diperlukan untuk mendalami kedalaman yang boleh diperhatikan. Tomografi tatasusunan sesuai untuk analisis terperinci tentang fenomena yang jarang berlaku di kawasan pemerhatian yang besar. Kami menjangkakan bahawa substrat telus seperti kaca membolehkan pelbagai kaedah korelatif, termasuk cahaya korelatif dan mikroskop elektron (CLEM). Tomografi tatasusunan berkesan untuk pemerhatian sel terapung, bakteria dan embrio yang mempunyai kekonduksian rendah, dikelilingi oleh resin di sekeliling sampel, kerana sampel adalah bahagian nipis pada substrat konduktif, pengecasan ditindas dan sampel boleh diperhatikan dengan voltan pecutan tinggi.
Rajah.3 Perbandingan kawasan cerapan dan kualiti imej bagi setiap kaedah.
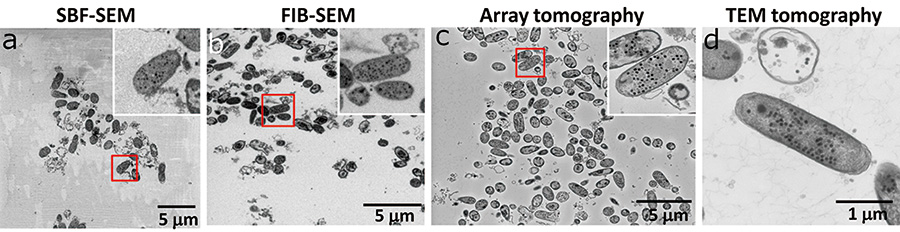
Dalam SBF-SEM, spesimen mudah dicas, merosot kualiti imej, kerana resin blok yang sedikit konduktif menduduki kawasan cerapan yang luas (a). FIB-SEM juga membolehkan untuk memerhatikan kawasan resin blok yang luas, tetapi ion galium yang memercikkan permukaan sampel menyekat pengecasan (b). Dalam tomografi Array, kami dapat memerhatikan imej nisbah isyarat-ke-bunyi (SN) yang tinggi, kerana pengecasan telah ditindas untuk bahagian nipis yang dihiris yang dipasang pada wafer silikon yang sangat konduktif (c). Dalam tomografi TEM, kami memerhatikan hanya satu E.coli (d).
Rajah.4 Perbandingan hasil pembinaan semula 3D.

Kami membina semula struktur 3D E.coli dijangkiti dengan T4 phages. Imej pemaparan volum bagi keseluruhan kawasan pemerhatian (iklan). Imej pembahagian satu E.coli sel yang dijangkiti T4 phages (hijau), T4 phages yang tumbuh di dalamnya E.coli (oren), dan dijangkiti (merah jambu) (eh). Imej pembahagian satu faj T4 masuk E.coli (il).
Jadual 2 Ringkasan ciri-ciri analisis struktur 3D oleh mikroskop elektron.
| SBF-SEM | FIB-SEM | Tomografi tatasusunan | Tomografi TEM | |
|---|---|---|---|---|
| medan pandangan (X,Y) | 100 μm lebih | 1~100 μm | 100 μm | 5 μm kurang |
| Kedalaman medan pandangan (Z) | Sangat dalam | Deep | Sempit | Sangat sempit |
| peleraian 3D (Z) | 50 nm | 20 nm | 70 nm | 1 nm |
| Masa perolehan | Beberapa dekad milik kita | Beberapa hari | Beberapa hari | 1~2 jam |
| usaha untuk pemerolehan | Little | Little | Besar | Little |
| Sampel yang optimum | Tisu, Otak | Tisu, Sel kultur | Tisu, Embrio, Sel kultur | Organel, Virus |
| Aplikasi yang optimum | Conectome, Analisis menyeluruh | Pemerhatian morfologi, Analisis kuantitatif | Analisis kuantitatif, CLEM | Pemerhatian morfologi |
Analisis imej pembinaan semula 3D
① Hubungan morfologi bagi E.coli yang dijangkiti oleh faj T4 dan zarah faj dalaman
SBF-SEM sudah cukup untuk menganalisis morfologi E.coli dan pengedaran T4 phage. Kami menganalisis hubungan morfologi E.coli dan fag dalaman dengan menggunakan hasil SBF-SEM. Mula-mula kita mengkaji hubungan antara isipadu E.coli dan bilangan faj (Rajah 5 a). Keputusan menunjukkan bahawa bilangan maksimum faj dalaman dalam an E.coli adalah kira-kira 280 zarah, dan tidak E.coli mengandungi lebih banyak zarah fag boleh diperhatikan. Kami menganggap bahawa apabila bilangan zarah phage meningkat lagi, peningkatan ini menyebabkan E.coli untuk pecah. Bilangan zarah fag yang terkandung cenderung meningkat, kerana isipadu E.coli bertambah. Walau bagaimanapun, hubungan ini tidak linear; terdapat perbezaan dalam bilangan zarah faj walaupun dalam isipadu yang sama E.coli (B dan C, D, E dalam Rajah 5 a). Oleh itu, kami memilih ciri E.coli (AE dalam Rajah 5 a, c). Dipilih E.coli sel adalah seperti berikut. Isipadunya kecil dan ia mempunyai sedikit zarah fag (A, B dalam Rajah 5 a, c). Yang seterusnya juga isipadu kecil, tetapi ia mempunyai banyak zarah fag (CE dalam Rajah 5 a, c). Satu lagi adalah isipadu yang besar dan ia mempunyai banyak zarah faj (F dalam Rajah 5 a, c). E.coli sel dibahagikan kepada tiga bahagian dalam arah paksi panjang, bahagian tengah, bahagian tengah, dan bahagian sisi. Kami menganalisis bahagian mana zarah fag T4 disetempat (Rajah 5 b). Kebanyakan zarah fag disetempat di bahagian tengah, apabila zarah fag adalah sedikit. Zarah fag yang disetempat di bahagian tengah tersebar dari bahagian tengah ke bahagian sisi, apabila zarah fag dalaman meningkat. Tambahan pula, sebagai jumlah E.coli meningkat, zarah faj di bahagian tengah berkurangan lebih banyak, dan zarah faj yang disetempat di bahagian sisi meningkat. Seterusnya, kami memberi tumpuan kepada bentuk E.coli . Bentuknya E.coli yang mempunyai sedikit zarah fag T4 adalah bentuk seperti rod (Rajah 5 c B). Apabila zarah fag T4 dalaman meningkat, E.coli berkembang ke arah paksi pendek, dan bentuknya menjadi bentuk seperti tong (Rajah 5 c CE).
Rajah.5 Hubungan morfologi bagi E.coli dan terlibat phages.
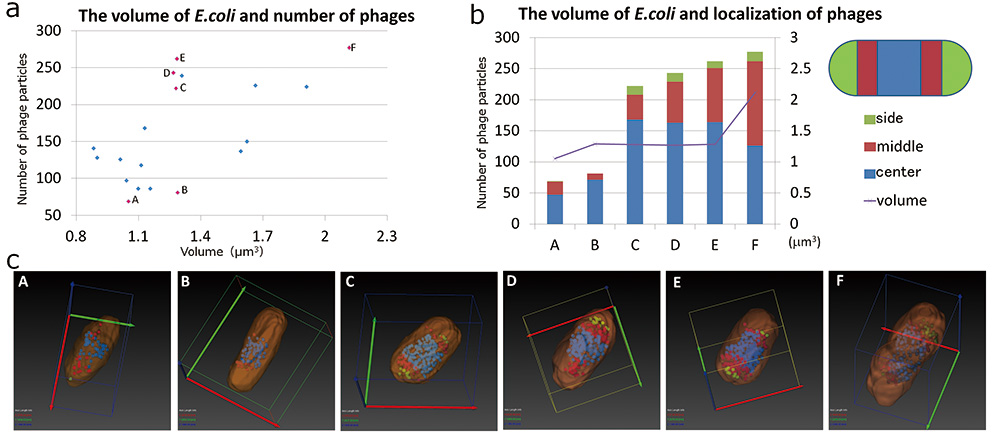
Graf kiri menunjukkan hubungan isipadu bagi E.coli dijangkiti dengan T4 phage dan bilangan yang terlibat T4 phage (a). Kami memilih enam ciri E.coli sel (titik merah jambu dalam graf kiri, AF). Morfologi 6 ini E.coli sel yang melibatkan fag T4 telah divisualisasikan dengan pembahagian (c), graf kanan menunjukkan hubungan isipadu E.coli dan taburan T4 phage (b).
② Hubungan antara jenis phage dan taburan phage in E.coli
T4 phage boleh dikenali oleh mana-mana analisis struktur 3D dengan SEM kerana ia mempunyai kontras yang kuat dalam E.coli . Walau bagaimanapun, λ phage dan φ174 phage sukar untuk dikenali E.coli kerana mereka mempunyai kontras yang rendah E.coli , dan φ174 faj adalah terlalu kecil (Rajah 2 e, c, f). Oleh itu, perbandingan daripada E.coli dijangkiti oleh T4 phage, λphage dan φ174 phage telah dilakukan menggunakan imej pembinaan semula 3D oleh tomografi Array. Mula-mula kita memberi tumpuan kepada morfologi E.coli . Bentuknya E.coli yang dijangkiti oleh λphage berubah daripada struktur seperti batang kepada struktur seperti bola. Kami berpisah E.coli phages yang dijangkiti kepada tiga lapisan; lapisan dalam, lapisan tengah, dan lapisan luar, dan menyiasat fag mana yang disetempat di lapisan mana (Rajah 6 a). Keputusan menunjukkan bahawa faj T4 dan φ174 faj tersebar masuk E.coli tanpa berat sebelah, walau bagaimanapun, zarah hampirλ phage disetempat di lapisan luar. T4 phage dan φ174 phage ialah lytic phage. Sebaik sahaja mereka dijangkiti E.coli , mereka mula membiak dalam sel perumah dan sel perumah pecah (lisis). Sebaliknya, λphage ialah fag sederhana. Apabila mereka dijangkiti E.coli dan menyuntik genom mereka ke dalam sel perumah, mereka tidak lisis serta-merta. Selepas jangkitan, mereka memasukkan genom mereka ke dalam genom perumah dan berkelakuan sebagai sebahagian daripada perumah (lisogenisasi). Walau bagaimanapun, penindas yang menyekat percambahan faj tidak diaktifkan oleh perubahan persekitaran, faj mula membiak dan perumah melisis. Perbezaan dalam perubahan morfologi yang diperhatikan dan penyetempatan faj mungkin berasal dari kawasan percambahan, faj litik membiak di kawasan yang dijangkiti serta-merta dan faj sederhana membiak pada genom perumah.φ174 faj tidak menunjukkan taburan berat sebelah dalam tiga lapisan, tetapi ia disetempat dalam bahagian tertentu (Rajah 6 d). Dalam eksperimen ini, kami tidak dapat mengenal pasti tempat pertama dijangkiti, tetapi tempat setempat mungkin berkaitan dengan tempat pertama dijangkiti.
Rajah 6 Taburan 3D bagi fag dalam E.coli
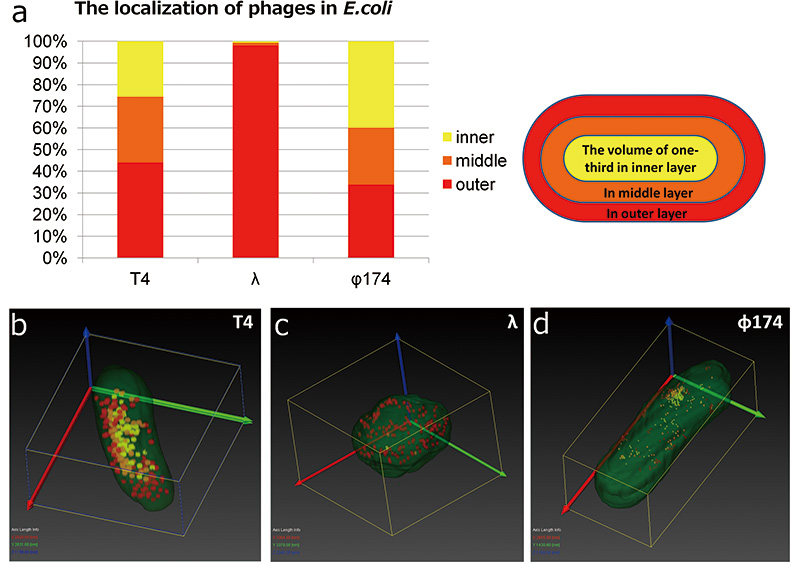
Kami membandingkan pengedaran phage daripada hasil pembinaan semula struktur 3D T4 phage, λphage, dan φ174 phage form Array tomography. Kami berpisah E.coli kepada tiga bahagian; kawasan dalam, kawasan tengah dan kawasan luar, dan mengira bilangan faj yang terlibat dalam setiap bahagian. T4 phages dan φ174 phages mempunyai sedikit bias pengedaran, namun hampirλphages disetempat di kawasan luar (a). E.coli yang dijangkiti λphage menukar bentuknya daripada rod kepada globular (c).
Kesimpulan
Setiap kaedah pembinaan semula 3D dengan SEM mempunyai kekuatan dan kelemahan tersendiri bergantung pada penyediaan sampel dan keadaan pemerolehan seperti voltan pecutan. Dalam SBF-SEM dan FIB-SEM, pemerolehan data dilakukan secara automatik, sebaliknya, selepas analisis segmentasi sering dilakukan secara manual. Segmentasi yang mengekstrak tisu dan kawasan yang menarik sering dilakukan berdasarkan kontras imej. Walau bagaimanapun, sampel biologi mempunyai perbezaan kecil dalam kontras, dan kadangkala kontras sahaja mungkin tidak menentukan pembahagian. Adalah mungkin untuk membahagikan dengan morfologi sebagai mercu tanda dengan mengekalkan resolusi tinggi imej, dan dengan itu ia membantu meningkatkan kecekapan pembahagian. SBF-SEM dan FIB-SEM perlu memperkenalkan instrumen khusus, manakala tomografi Array boleh dimulakan dengan SEM konvensional dan ultramikrotom, tetapi beberapa kemahiran diperlukan. Pilihan kaedah mana yang hendak digunakan adalah strategi penting dalam mempromosikan penyelidikan dengan cekap. Kami berharap kertas kerja ini berguna untuk penyelidik yang merancang untuk memulakan analisis 3D dengan mikroskop elektron.
Penghargaan
Penulis ingin mengucapkan terima kasih kepada orang JEOL yang menyokong kajian ini; H. Nishioka kerana menyokong pengurusan dalam kajian ini, M. Suga untuk sokongan pemerolehan data tomografi Array, H. Matsushima untuk sokongan pemerolehan data dengan FIB-SEM, Y. Yamaguchi untuk perbincangan berguna dan bimbingan teknikal SBF- SEM, K. Hasumi atas sokongan segmentasi. Penulis juga berterima kasih kepada Institut Teknologi dan Penilaian Negara, Institut Sains dan Teknologi Industri Termaju Negara kerana menyediakan E.coli dan phages.
Rujukan
- Knott G, Marchman H, Wall D, Lich B. Mikroskopi elektron pengimbasan bahagian bersiri tisu otak dewasa menggunakan pengilangan rasuk ion terfokus. J Neurosci. (2008).
- Micheva KD, Smith SJ. Tomografi tatasusunan: alat baharu untuk pengimejan seni bina molekul dan ultrastruktur litar saraf. Sel-sel otak. (2007).
- Deerinck, TJ & Bushong, Eric & Thor, A & Ellisman, Mark. Kaedah NCMIR untuk 3D EM: Protokol baharu untuk penyediaan spesimen biologi untuk mikroskop elektron pengimbasan muka blok bersiri. Nat Center Microsc Imag Res. 6-8. (2010).
- Denk W, Horstmann H. Mikroskopi elektron pengimbasan blok muka bersiri untuk membina semula struktur nano tisu tiga dimensi. PLoS Biol. (2004).
- Schindelin J, Arganda-Carreras I, Frize E, Kaynig V, Longair M, Pietzsch T, Preibisch S, Rueden C, Saalfeld S, Schmid B, Tinevez JY, White DJ, Hartenstein V, Eliceiri K, Tomancak P, Cardona A. Fiji: platform sumber terbuka untuk analisis imej biologi. Kaedah Nat. (2012).
Rumusan berdasarkan bidang
Adakah anda seorang profesional perubatan atau kakitangan yang terlibat dalam penjagaan perubatan?
Tidak
Sila diingatkan bahawa halaman ini tidak bertujuan untuk memberikan maklumat tentang produk kepada orang ramai.
