Perkembangan Teknikal Kryomikroskopi Elektron dan Sumbangan kepada Sains Hayat
BERITA JEOL Jld.53 No.3
Keiichi Namba dan Takayuki Kato
Sekolah Siswazah Biosains Frontier, Universiti Osaka
Struktur tiga dimensi makromolekul biologi dan kompleksnya adalah maklumat asas bukan sahaja untuk sains hayat tetapi juga untuk sains perubatan dan reka bentuk ubat. Kriomikroskopi elektron kini menarik banyak perhatian sebagai alat yang berkuasa untuk analisis struktur resolusi tinggi sebagai tambahan kepada kristalografi sinar-X dan NMR yang telah digunakan sebagai teknik asas. Bagaimanakah struktur biomolekul boleh digambarkan dan dianalisis pada resolusi tahap atom dalam keadaan asalnya walaupun ia mudah rosak oleh tahap penyinaran elektron yang agak rendah? Kertas kerja ini menerangkan sejarah dan keadaan semasa perkembangan teknologi kita sendiri dalam cryomicroscopy elektron dan juga jangkaan dan prospek masa depan oleh pembangunan selanjutnya.
Pengenalan
Hadiah Nobel Kimia 2017 telah dianugerahkan kepada Jacques Dubochet (Universiti Lausanne, Switzerland), Joachim Frank (Universiti Columbia, Amerika Syarikat), dan Richard Henderson (MRC Laboratory of Molecular Biology, UK), atas kerja perintis mereka dalam pembangunan elektron cryomicroscopy dan analisis imej untuk analisis struktur makromolekul biologi, seperti protein dan asid nukleik. Struktur tiga dimensi (3D) biomolekul ialah maklumat asas dan penting bukan sahaja untuk sains hayat tetapi juga untuk sains perubatan dan reka bentuk ubat, dan cryomicroscopy elektron (cryoEM) telah menjadi alat yang berkuasa untuk analisis struktur resolusi tinggi sejak masa lalu. beberapa tahun dan kini menetapkan kedudukannya sebagai salah satu teknik penting untuk analisis struktur sebagai tambahan kepada kristalografi sinar-X dan NMR konvensional. Kryomicroscopy elektron menerima banyak perhatian kerana ia boleh mencapai resolusi hampir atom dalam analisis struktur hanya dengan jumlah sampel larutan yang sangat kecil, sekecil beberapa puluh μgs, tanpa memerlukan penghabluran. Hadiah Nobel dianugerahkan untuk mengiktiraf sumbangan tiga penyelidik di atas sebagai pengasas teknologi ini. Di sini, kami menerangkan konsep kriomikroskopi elektron dan analisis imej sebagai teknik untuk biologi struktur, sejarah dan keadaan semasa perkembangan teknologi kita sendiri, dan potensi masa depan teknik ini untuk kehidupan dan sains perubatan melalui pembangunan selanjutnya.
Analisis struktur makromolekul biologi oleh cryomicroscopy elektron
Mekanisme asas yang mendorong dan menyokong aktiviti biologi sangat dikongsi oleh pelbagai organisma, daripada mikroorganisma, seperti bakteria dan yis, kepada organisma multisel, seperti haiwan dan tumbuhan serta manusia dengan fungsi otak peringkat tinggi. Kesemua fungsi ini ditentukan berdasarkan struktur protein dan asid nukleik dengan susunan 3D bagi banyak atom, daripada beberapa ribu hingga puluhan ribu. Selain itu, strukturnya tidak pepejal seperti bahan pukal logam dan seramik tetapi sangat dinamik dan fleksibel dan direka bentuk untuk berfungsi dengan menggunakan turun naik haba secara aktif. Salah satu cabaran utama dalam sains hayat ialah penjelasan mekanisme yang menentukan dan menyatakan fungsi ini, dan adalah perlu untuk melihat struktur 3D bagi begitu banyak makromolekul biologi di pelbagai negeri yang terlibat dalam pelbagai fungsi biologi. Bilangan struktur 3D yang perlu kami selesaikan terdiri daripada beberapa ratus ribu hingga beberapa juta.
Ciri kuat cryoEM, terutamanya analisis imej zarah tunggal, ialah tidak ada keperluan untuk penghabluran sampel yang penting untuk kristalografi sinar-X dan hampir tiada had atas dalam saiz kompleks molekul tidak seperti NMR. Walau bagaimanapun, memandangkan majoriti ikatan interatomik yang mengekalkan struktur 3Dnya ialah ikatan bukan kovalen, seperti ikatan hidrogen, jambatan garam dan hubungan van der Waals, struktur tersebut sangat sensitif terhadap kerosakan sinaran pancaran elektron, beberapa urutan magnitud lebih teruk. daripada logam, seramik dan semikonduktor. Oleh itu, untuk merakam imej makromolekul biologi beresolusi tinggi dalam keadaan asalnya tanpa banyak kerosakan, adalah perlu untuk membenamkannya dalam filem nipis ais amorf dengan cepat membekukan larutan berairnya dan merekodkan imejnya dengan cryomicroskop elektron penghantaran (cryoTEM) dengan peringkat spesimen yang disejukkan oleh helium cecair atau nitrogen cecair kepada suhu yang cukup rendah untuk menghalang ais vitreous daripada bertukar kepada keadaan hablur. Walaupun pada suhu yang begitu rendah, dos elektron yang boleh disinari tanpa banyak kerosakan pada struktur tahap atom adalah terhad kepada 20 hingga 30 e.-/Å2, dan imej cryoEM cenderung sangat lemah disebabkan oleh bunyi statistik intrinsik, yang disebabkan oleh bilangan elektron yang agak kecil yang dikesan dalam setiap piksel pengesan imej, dan hingar Landau, yang disebabkan oleh pengedaran yang besar tahap isyarat pengesanan elektron individu. Memandangkan imej molekul individu yang dirakam oleh cryoTEM ialah imej unjuran 2D bagi molekul yang tertanam dalam filem ais amorf dalam pelbagai orientasi, ia juga perlu untuk mengumpul sejumlah besar imej yang mencukupi untuk meliputi orientasi berbeza dengan pengedaran sekata untuk membina semula. imej 3D pada resolusi tinggi. Oleh itu, adalah penting untuk mengumpul seberapa banyak imej molekul yang mungkin, mengklasifikasikannya ke dalam setiap orientasi unjuran, dan mendapatkan imej purata untuk setiap orientasi dengan menjajarkan kedudukan dan orientasi imej molekul untuk meningkatkan tahap isyarat sambil mengurangkan hingar. . Prosedur ini dipanggil purata kelas 2D. Kemudian, hubungan relatif antara imej purata kelas 2D dalam orientasi unjuran ditentukan, dan akhirnya imej 3D molekul boleh dibina semula (Rajah 1). Untuk mencapai analisis struktur resolusi tinggi, adalah penting untuk menggunakan cryoTEM dan pengesan imej yang kedua-duanya mampu mengumpul imej cryoEM yang berkualiti tinggi dan resolusi tinggi dengan cekap. Program analisis imej berketepatan tinggi dan komputer berkelajuan tinggi juga diperlukan. Kami akan menerangkan sejarah pembangunan sistem cryoTEM kami sendiri untuk menyelesaikan masalah tersebut dan beberapa pencapaian dengan menggunakannya.
Rajah 1 Gambarajah skematik menerangkan proses analisis imej zarah tunggal.
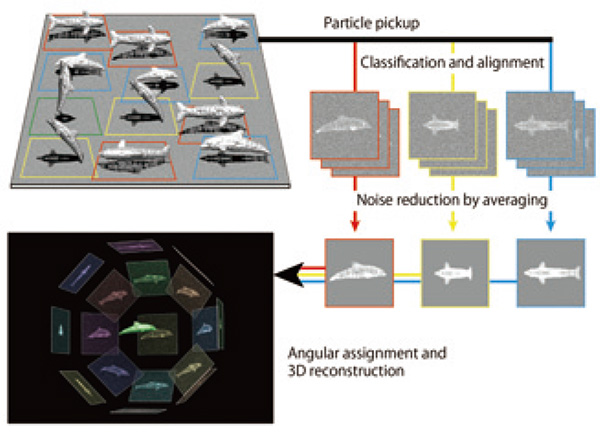
Ikan lumba-lumba mewakili biomolekul yang tertanam dalam filem nipis ais vitreous dalam pelbagai orientasi. Imej CryoEM sepadan dengan unjuran 2D mereka dengan tahap hingar yang tinggi. Selepas S/N meningkat dengan banyak melalui pengelasan 2D dan purata banyak unjuran 2D, imej 3D boleh dibina semula.
Kemajuan dalam cryoTEM, pengesan imej dan kaedah pengumpulan dan analisis data
Pistol elektron pelepasan medan
Perintis bidang cryoEM di Jepun ialah Yoshinori Fujiyoshi (Profesor Pelawat, Universiti Nagoya). Dengan kerjasama JEOL, beliau telah mereka bentuk dan membangunkan cryoTEM dengan peringkat spesimen sejukan helium cecair yang sangat stabil untuk pertama kali di dunia untuk meminimumkan kerosakan penyinaran pancaran elektron ke had untuk membolehkan rakaman imej cryoEM berkualiti tinggi bagi biologi. makromolekul [1]. Saya mula bekerjasama dengannya dari sekitar tahun 1990 untuk mula menggunakan cryomicroscopy elektron untuk analisis struktur filamen flagellar bakteria untuk memahami mekanisme pemasangan dan supercoilingnya. Kami telah menggunakan pembelauan gentian sinar-X dan kristalografi sinar-X pada masa itu kerana resolusi yang boleh dicapai oleh kriomikroskopi elektron agak terhad pada masa itu, tetapi saya menyedari potensi cryoTEM dengan peringkat spesimen yang disejukkan helium cecair untuk struktur resolusi tinggi. analisis. Beliau mengajar kami asas teknik cryoEM daripada penyediaan grid cryoEM kepada pengimejan dos minimum kompleks protein terbenam ais terhidrat beku. Kemudian, setahun atau lebih kemudian, saya ditawarkan pekerjaan daripada Tsuneharu Nitta, Pengarah Makmal Penyelidikan Pusat Panasonic (Matsushita Electric Industrial Co., Ltd. pada masa itu), untuk memulakan makmal saya sendiri dalam subbahagian Makmal Penyelidikan Teknologi Termaju, yang Panasonic merancang untuk menubuhkan di KeiHanNa Science City sebagai pusat R&D berorientasikan asas penyelidikannya yang baharu. Bahagian kecil itu dipanggil Institut Antarabangsa untuk Penyelidikan Lanjutan (IIAR), dan saya telah dijanjikan untuk mempunyai pembiayaan yang besar untuk pembangunan peralatan baharu untuk analisis struktur sinar-X dan cryomicroscopy elektron. Jadi saya meminta Yoshinori Fujiyoshi untuk menyertai institut Panasonic baharu ini untuk memulakan IIAR bersama-sama sebagai pusat penyelidikan biofizik struktur termaju. Kami meminta JEOL memperkenalkan peranti yang baru dibangunkan, senapang elektron pelepasan medan jenis Schottky (Thermal FEG), kepada cryoTEM yang dinyatakan di atas dengan peringkat spesimen yang disejukkan dengan helium cecair. Ini adalah cryoTEM pertama dengan FEG dan dinamakan JEM-3000SFF (Generasi 3: G3) (Rajah XNUMX). 2) [1]. Panasonic menubuhkan institut KeiHanNa baharu pada tahun 1994, dan kami berpindah ke bangunan baharu dan menyediakan makmal kami dengan cryoTEM baharu ini. Kami menjangkakan peningkatan yang ketara dalam kualiti dan resolusi imej EM dengan koheren tinggi pancaran elektronnya mengikut pelepasan medan. Peningkatan itu sebenarnya luar biasa, menunjukkan isyarat resolusi yang lebih tinggi dalam setiap imej cryoEM yang kami kumpulkan. Kumpulan Fujiyoshi bertujuan untuk menyelesaikan struktur protein membran, seperti bacteriorhodopsin dan aquaporin, dalam kristal dua dimensi, dan kumpulan kami bertujuan untuk menganalisis struktur himpunan heliks besar makromolekul, seperti filamen flagellar bakteria. Oleh kerana hanya filem fotografi yang tersedia sebagai pengesan imej pada zaman itu, kecekapan dan pemprosesan pengumpulan data imej berkualiti tinggi adalah sangat lemah. Oleh itu, ia mengambil masa lebih daripada beberapa tahun untuk analisis struktur mencapai resolusi hampir atom, tetapi kami dapat memperoleh banyak hasil yang memberi kesan pada pertengahan tahun 2000-an, dengan struktur resolusi atom bagi kristal 2D protein membran dan kompleks makromolekul [2-6 ]. Analisis struktur kami bagi filamen flagellar bakteria mencapai resolusi hampir 4 Å dengan analisis imej yang teliti bagi imej cryoEM berkualiti tinggi yang terpilih bagi filamen yang sepadan dengan hanya 40,000 molekul flagellin, dan lipatan tulang belakang polipeptida dan rantai sisi besar telah diselesaikan dengan jelas. (Gamb.
Rajah 2 Sejarah perkembangan cryoTEM dalam kumpulan kami.

Teknologi dan peralatan unsur yang baru digabungkan ditunjukkan dalam aksara merah.
Rajah 3 Struktur molekul filamen flagellar yang didedahkan oleh analisis imej cryoEM.
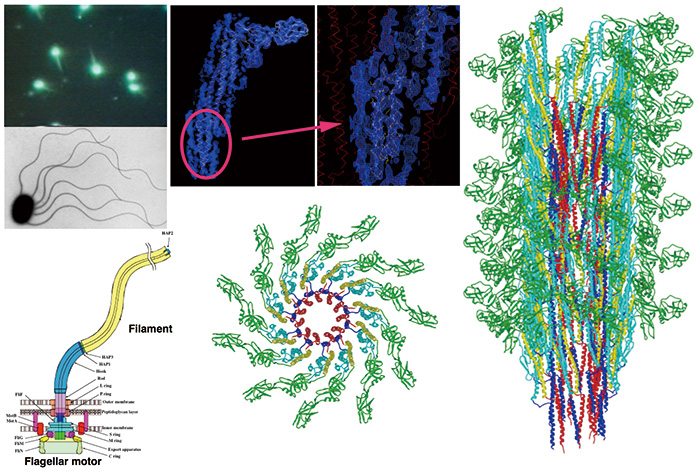
Flagelum bakteria ialah organel motilitas dengan motor berputar dan kipas berfilamen heliks. Filamen flagellar ialah himpunan heliks besar berpuluh-puluh ribu molekul flagellin. Dengan menggunakan cryoTEM JEM-3000SFF dan filem fotografi sebagai pengesan imej, kami mengumpul imej cryoEM dan menyelesaikan struktur filamen flagellar pada resolusi sekitar 4 Å. Lipatan rantai utama dan banyak rantai sisi besar telah divisualisasikan dengan jelas buat kali pertama oleh analisis imej cryoEM biomolekul, dan ini membolehkan kami membina model atom lengkap pemasangan protein besar ini.
Kamera CCD dan penapis tenaga jenis Ω
Sekolah Siswazah Biosains Frontier telah ditubuhkan di Universiti Osaka pada tahun 2002, dan kami memindahkan makmal kami ke bangunan Nanobiologi pada tahun 2004. Sebelum itu, kami memperoleh pembiayaan kerajaan daripada MEXT sebagai sebahagian daripada belanjawan tambahannya dan meminta JEOL memperkenalkan beberapa peranti yang baru dibangunkan ke cryoTEM dengan peringkat spesimen yang disejukkan dengan helium cecair. Ini ialah JEM-3200FSC (Rajah 2) dan merupakan versi yang dipertingkatkan bagi cryoTEM generasi keempat Fujiyoshi (G4) [1] yang telah diperkenalkan kepada Institut Penyelidikan Riken Harima di tapak SPring-8. Salah satu peranti baharu ialah versi penambahbaikan penapis tenaga jenis Ω dalam lajur, dan ini diperkenalkan untuk menambah baik nisbah isyarat kepada hingar (S/N) imej cryoEM dengan mengalih keluar sebahagian besar elektron yang bertaburan secara tidak kenyal, yang hilang. keselarasan disebabkan kehilangan tenaga dan oleh itu hanya menyumbang kepada hingar latar belakang yang tinggi dan bukan kepada imej EM resolusi tinggi. Kami mendapati peningkatan hampir dua kali ganda dalam imej S/N hanya dengan penapis tenaga ini [7]. Peranti lain ialah pengesan imej CCD 4K × 4K (TVIPS F415MP), yang telah digunakan untuk rakaman pembelauan elektron tetapi bukan untuk pengimejan kerana kuasa penyelesaiannya yang lebih rendah daripada filem fotografi. Kuasa penyelesaiannya adalah lebih rendah kerana setiap elektron yang membentuk imej EM perlu ditukar kepada foton oleh lapisan nipis scintillator di atas blok gandingan gentian kaca dan imej setiap elektron menjadi kabur oleh penyerakan elektron dalam scintillator. Walaupun dengan kelemahan ini, CCD telah meningkatkan kecekapan dan pemprosesan pengumpulan data imej berkualiti tinggi dengan ketara kerana kita dapat melihat imej EM dan transformasi Fouriernya serta-merta selepas pendedahan, dan ini membolehkan kita membuat pertimbangan yang cepat dan boleh dipercayai mengenai kualiti dan resolusi imej cryoEM individu semasa pengumpulan data [7]. Kami juga dapat meningkatkan kecekapan pengumpulan data imej berkualiti tinggi secara mendadak dengan meningkatkan suhu spesimen daripada 4 K kepada sekitar 50 K dengan menghentikan bekalan helium cecair dari tangki dalam lajur ke pod spesimen masuk atas. Walaupun kerosakan sinaran boleh diminimumkan pada 4 K, kebanyakan imej cryoEM mengalami kekaburan imej tempatan, pincang arah disebabkan oleh cas yang meningkat apabila penyinaran pancaran elektron kerana kekonduksian elektrik yang sangat lemah bagi filem ais spesimen nipis pada tahap yang sangat rendah. suhu. Ia adalah kurang daripada beberapa % daripada imej yang dikumpul yang boleh digunakan untuk analisis imej. Kami menyelesaikan masalah sukar ini dengan meningkatkan suhu spesimen kepada kira-kira 50 K, dan hampir semua imej yang dikumpul menjadi berkualiti tinggi yang mencukupi untuk digunakan untuk analisis imej [7].
Penambahbaikan dan kemajuan teknologi ini membuat projek berbilang tahun sebelum ini disiapkan dalam masa beberapa minggu daripada pengumpulan data kepada pembinaan semula imej 3D dan membolehkan kami menyelesaikan struktur pelbagai himpunan biomolekul yang menarik, seperti cangkuk flagellar bakteria, filamen aktin otot, filamen ParM yang mengasingkan plasmid untuk pembahagian sel bakteria, tiub jarum nipis sistem rembesan virulensi jenis-III bakteria patogen dan kompleks ketegaran actomyosin, semuanya pada resolusi 5 - 7 Å. Kami dapat membina model atom yang boleh dipercayai untuk mendapatkan pandangan tentang mekanisme fungsinya dengan melabuhkan dan menapis struktur kristal yang ada pada peta 3D [7-12]. Struktur cakera bertindan yang dibentuk oleh protein kot virus mozek tembakau telah diselesaikan pada resolusi 3.8 Å juga dalam beberapa minggu untuk membolehkan banyak rantai sisi divisualisasikan (Takashi Fujii, tidak diterbitkan).
Tahap penyejukan cecair helium masuk sisi
Peringkat spesimen yang disejukkan helium cecair yang dibangunkan oleh Fujiyoshi pada tahun 1980-an adalah jenis kemasukan teratas. Ia secara mekanikal sangat stabil, tetapi kriotomografi elektron tidak dapat dilakukan kerana peringkat tidak mempunyai mekanisme kecondongan. Ciptaan khas telah dibuat untuk pengimejan kristal 2D dalam banyak sudut kecondongan yang berbeza untuk menampung sebahagian besar ruang Fourier 3D untuk pembinaan semula imej 3D resolusi tinggi, tetapi ia masih memakan masa. Jadi Fujiyoshi memutuskan untuk mereka bentuk semula peringkat kemasukan teratasnya untuk melaksanakan mekanisme condong dan memohon belanjawan MEXT yang dipanggil Dana Penyelarasan Khas untuk Promosi Sains dan Teknologi untuk pembangunannya oleh JEOL, dan saya menyertai projek ini sebagai pencadang bersama. Yang dibangunkan dalam projek ini ialah cryoTEM Generasi 6 (G6) (Rajah 2). JEOL membina dua daripadanya dan dihantar ke Universiti Kyoto dan Universiti Osaka pada tahun 2006 [1]. Salah satu subjek penyelidikan utama kami ialah motor flagellar bakteria, yang memutarkan filamen flagellar supergegelung sebagai kipas heliks untuk menghasilkan tujahan untuk motilitas renang bakteria. Kami memerlukan maklumat struktur terperinci badan basal flagellar yang merentangi membran sel untuk memahami mekanisme putaran motor, tetapi komponen penting motor, seperti unit stator, diasingkan daripada badan basal semasa pengasingan dan penulenannya melalui pelarutan detergen. kerana pengikatannya yang lemah, dan oleh itu struktur motor flagel tidak dapat diperhatikan dalam keadaan berfungsi apabila diasingkan daripada sel. Jadi apa yang kami sasarkan untuk dilakukan dengan cryoTEM baharu ini adalah untuk mewujudkan kaedah cryotomography elektron (ECT) untuk memerhati struktur in situ kompleks biomolekul di dalam sel. Kami cuba mewujudkan kaedah ECT dengan cryoTEM baharu ini dengan mekanisme kecondongan untuk menggambarkan struktur motor berfungsi dalam membran sel dengan cepat membekukan seluruh sel bakteria pada grid spesimen dan merekodkan banyak imej condong mereka untuk membina semula imej 3D sel. dengan badan basal flagellar. Walau bagaimanapun, memandangkan diameter sel Salmonella adalah hampir 1 μm tebal dan ketebalan spesimen untuk rasuk elektron melaluinya menjadi dua kali lebih tebal pada kecondongan 60º, yang terlalu tebal walaupun untuk 300 keV elektron melalui dan berselerak secara elastik untuk membentuk EM imej berkualiti baik, kami terpaksa menunggu selama beberapa tahun untuk menggambarkan struktur in situ badan basal sehingga kami telah memperkenalkan teknik kejuruteraan genetik untuk menghasilkan "sel mini" untuk menjadikan sel Salmonella jauh lebih kecil daripada jenis liar [13]. ].
Untuk meningkatkan lagi kecekapan dan daya pemprosesan pengumpulan data imej untuk analisis imej zarah tunggal, kami memutuskan pada tahun 2011 untuk menukar peringkat spesimen kepada jenis kemasukan sisi reka bentuk asal JEOL yang berpotensi untuk membolehkan pengumpulan data automatik melalui kawalan komputer. . Versi cryoTEM yang diubah suai ini ialah G6N (Generasi 6 dengan Pengubahsuaian Baharu) (Rajah 2).
Pengenalan peringkat spesimen ini bersama-sama dengan jenis kepingan tiang kanta objektif yang berbeza telah menghasilkan kebolehgunaan dan resolusi imej yang lebih baik di luar jangkaan kami. Salah satu kaedah standard untuk memeriksa resolusi imej tertinggi yang mungkin bagi cryoTEM ialah mengambil imej EM bagi spesimen ujian, seperti filem nipis aloi platinum-iridium (Pt/Ir) amorf, di bawah keadaan nyahfokus yang agak besar iaitu kira-kira 1 μm dan lihat pada transformasi Fouriernya untuk melihat sejauh mana gelang Thon memanjang (lihat Rajah 4). Inilah yang biasa kami lakukan untuk memeriksa resolusi imej cryoEM bagi spesimen tertanam ais terhidrat beku, dan penyahfokusan yang begitu besar diperlukan untuk meningkatkan kontras imej resolusi rendah untuk menjadikan biomolekul tertanam ais kelihatan untuk analisis imej. Dengan menggunakan filem aloi nipis, kita tidak dihadkan oleh dos elektron rendah yang mesti kita gunakan untuk mengelakkan kerosakan sinaran untuk melihat isyarat cincin Thon yang lemah pada resolusi tertinggi yang mungkin. Dengan ujian peleraian imej sedemikian yang dilakukan pada tarikh siap pemasangan cryoTEM G6N, kami dapat melihat cincin Thon melangkaui resolusi 2.0 Å. Untuk menjadikan cincin Thon memanjang ke resolusi tertinggi yang mungkin di bawah keadaan nyahfokus sedemikian, sistem optik elektron cryoTEM mesti ditetapkan untuk menghasilkan pancaran pencahayaan selari pada spesimen. Adalah bernasib baik kerana bahagian tiang kanta objektif cryoTEM ini direka untuk memenuhi keperluan sedemikian di bawah hampir semua keadaan pengimejan yang pengguna sediakan untuk mengumpul imej walaupun tidak sedar tentang keadaan pencahayaan selari.
Walau bagaimanapun, terdapat beberapa masalah lain. Walaupun peringkat spesimen disejukkan dengan helium cecair, suhu spesimen adalah lebih tinggi sedikit daripada jenis kemasukan teratas G4, dan suhu tidak boleh dinaikkan kepada 50 K seperti yang kami lakukan dengan jenis kemasukan teratas G4. Di samping itu, bekalan helium adalah terhad di seluruh dunia dan harga semakin meningkat. Kemudahan mikroskop kami disambungkan dengan paip pemulihan helium ke Pusat Suhu Rendah Universiti Osaka di kampus yang sama, tetapi talian pemulihan helium kami sering menyebabkan masalah pada operasi Pusat Suhu Rendah dengan mencemarkan udara. Jadi kami memutuskan untuk berhenti menggunakan helium cecair sekitar tahun 2012. Kami mengisi nitrogen cecair dalam kedua-dua tangki nitrogen cecair dan tangki helium cecair cryoTEM G6N dan mendapati bahawa suhu spesimen boleh disimpan secara stabil pada 77 K, tepat pada suhu nitrogen cecair selama 7 hingga 8 jam. Dengan menggunakan sepenuhnya perisian kawalan kamera CCD yang disediakan oleh TVIPS, pemerolehan data hampir automatik menjadi mungkin, dan ini menjadikan pengumpulan data imej cryoEM sangat cekap.
Rajah 4 Cincin Thon bagi imej filem nipis Pt/Ir yang dirakam dengan prototaip CRYO ARM™.
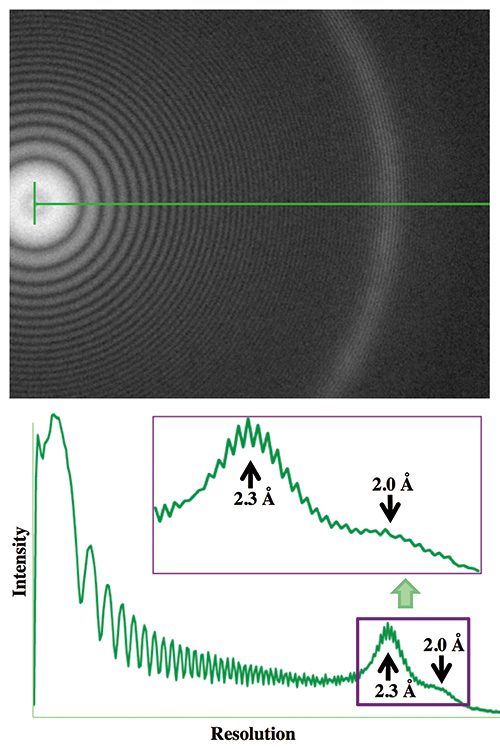
Imej cryoEM bagi filem nipis Pt/Ir telah diambil di bawah nyahfokus 1 μm dengan prototaip CRYO ARM™ dikendalikan pada 200 kV. Cincin Thon dalam transformasi Fouriernya dilanjutkan kepada resolusi 1.8 Å.
Kamera pengesan elektron langsung berasaskan CMOS
Dan akhirnya, masa cerah medan cryoEM telah datang pada tahun 2013 dengan ketibaan kamera pengesan elektron langsung berasaskan CMOS. David Agard dan rakan-rakannya di University of California, San Francisco, telah membangunkan pengesan imej EM dengan kerjasama Gatan, salah satu pengeluar kamera EM utama dengan menggunakan semula peranti CMOS untuk pengesan imej X-ray yang dibangunkan oleh kumpulan di Universiti California, Berkeley. Gatan menyelesaikan pembangunan sistem kamera ini dan menjadikannya tersedia secara komersial pada tahun 2013 sebagai K2 Summit. Cip pengimejan CMOS mempunyai spesifikasi yang menarik, mempunyai piksel 4K kali 4K, teguh terhadap penyinaran langsung elektron bertenaga tinggi yang dipercepatkan kepada 300 keV atau lebih tinggi, dan menunjukkan kekaburan imej yang minimum disebabkan oleh penyerakan elektron dalam semikonduktor pengesan elektron yang sangat nipis lapisan, dan yang terbaik, kadar pemerolehan data 16 juta piksel imej ialah 400 bingkai sesaat, yang memungkinkan untuk menjalankan pengiraan elektron tunggal. Kerana jumlah dos elektron yang biasanya digunakan untuk rakaman imej cryoEM ialah 20 hingga 30 e-/Å dalam pendedahan satu saat, bilangan elektron yang masuk ke satah pengesan bagi setiap bingkai menjadi terhad dan boleh dikira jika kadar dos diturunkan kira-kira 10 kali ganda dengan menjadikan masa pendedahan 10 kali ganda lebih lama. Pengiraan elektron tunggal memberi kita kelebihan besar dalam mengurangkan tahap hingar imej. Salah satu sumber hingar utama dalam rakaman imej cryoEM ialah bunyi statistik, yang besar berbanding isyarat kerana bilangan elektron yang membentuk imej cryoEM individu adalah kecil disebabkan oleh pengimejan dos rendah untuk mengelakkan kerosakan sinaran. Tidak ada cara untuk melarikan diri daripadanya. Walau bagaimanapun, pengiraan elektron tunggal boleh meminimumkan hingar Landau, iaitu hingar intrinsik pengesan yang disebabkan oleh taburan besar dalam amplitud isyarat yang mana-mana jenis pengesan imej terkumpul tenaga, seperti CCD, menghasilkan untuk pengesanan elektron individu.
Yifan Cheng di University of California, San Francisco, memanfaatkan sepenuhnya prestasi sistem kamera CMOS ini dan mencipta cara untuk mengumpul imej protein cryoEM berkualiti tinggi yang tajam melalui pengimejan mod filem dan pembetulan gerakan. Dia dan rakan-rakannya berjaya menganalisis struktur 3D protein membran, saluran ion reseptor TRPV1, yang merasakan haba dan kepedasan, daripada sejumlah kecil sampel larutan yang mengelakkan penghabluran selama bertahun-tahun walaupun banyak usaha oleh sekumpulan rakan sekerjanya. , dan menerbitkan dua kertas kerja dalam Nature pada akhir 2013 [14, 15]. Struktur telah diselesaikan pada resolusi 3.4 Å dengan menganalisis kira-kira 100,000, 1,000 imej zarah tunggal protein yang diambil daripada kira-kira 80, 5 imej cryoEM yang diperoleh daripada sejumlah kecil larutan sampel yang mengandungi protein terlarut detergen. Selepas pemprosesan bingkai individu untuk pengiraan elektron tunggal, mereka menambah setiap 16 bingkai untuk membuat filem cryoEM sebanyak XNUMX bingkai/saat dan kemudian menambah bingkai filem ini dengan pembetulan gerakan untuk meminimumkan kekaburan imej yang disebabkan oleh hanyut mekanikal peringkat spesimen dan herotan filem ais yang disebabkan oleh penyinaran elektron untuk menjadikan imej cryoEM akhir sangat tajam [XNUMX].
Kami dapat memperkenalkan Sidang Kemuncak Gatan K2 kepada cryoTEM G6N kami (Rajah 2) pada tahun 2015 dan cuba menggunakan prestasi tingginya sebagai pengesan imej. Rakaman imej mod filem membolehkan kami menangkap struktur pelbagai biomolekul termasuk protein membran pada resolusi hampir atom, dan resolusi tertinggi yang kami capai ialah 2.7 Å untuk struktur tiub jarum nipis sistem rembesan faktor virulensi jenis Shigella III (Takashi Fujii & Yurika Yamada, tidak diterbitkan). Oleh kerana resolusi yang boleh dicapai bergantung sebahagian besarnya pada kestabilan struktur molekul sampel dan ketebalan filem nipis ais pada grid cryoEM, adalah mungkin untuk mencapai resolusi melebihi 2.0 Å dengan spesimen dan grid yang lebih baik.
Pembangunan CRYO ARM™
Syarikat FEI (Thermo Fisher Scientific sejak 2017), salah satu pengeluar utama mikroskop elektron, mula membangunkan cryoTEM mesra pengguna berprestasi tinggi untuk penyelidik dalam sains hayat sekitar penghujung 1990-an dan menghasilkan cryoTEM yang dipanggil Polara pada 2004 dan Titan Krios pada tahun 2008. Titan Krios khususnya adalah sistem yang mesra pengguna, mampu menyimpan 12 grid cryoEM dalam majalah, membolehkan pengguna memuatkan setiap grid ke peringkat spesimen yang disejukkan oleh nitrogen cecair kepada sekitar 90 K oleh peranti pemuatan automatik (autoloader), dan membenarkan pengumpulan data imej automatik dengan menentukan kawasan untuk rakaman imej selepas pengguna menilai kualiti grid. Titan Krios telah dinilai tinggi oleh ramai pengguna dalam bidang cryoEM di seluruh dunia kerana prestasinya yang tinggi dalam mencapai resolusi tinggi dan kemesraan pengguna dalam pemerhatian 3D struktur selular oleh ECT dan analisis imej zarah tunggal kerana kedua-dua teknik memerlukan banyak cryoEM data imej untuk dikumpul.
JEOL membangunkan JEM-ARM200F (ARM: Atomic Resolution Microscope) pada tahun 2009 sebagai TEM resolusi tinggi untuk penyelidikan bahan dan menerima penilaian tinggi di dunia. Jadi kami fikir JEOL harus membangunkan cryoTEM berasaskan ARM menggunakan optik elektron resolusi ultra tingginya dengan membangunkan peranti yang diperlukan, seperti peringkat spesimen cecair nitrogen cecair dikawal komputer yang sangat stabil yang boleh memaksimumkan prestasi optik elektron resolusi tinggi , pemuat auto grid cryoEM yang lebih mesra pengguna dan mudah digunakan berbanding Titan Krios, dan sistem pengisian automatik nitrogen cecair, dan juga dengan menambahkan penapis tenaga dalam lajur jenis Ω untuk meminimumkan elektron yang bertaburan secara tidak kenyal kepada meningkatkan S/N imej yang dirakam. Penapis Ω juga berguna untuk mengukur ketebalan filem ais dengan cepat untuk penilaian dan penilaian kualiti grid EM. Pada masa yang tepat, pembiayaan besar yang dinamakan Program Penubuhan Infrastruktur Penyelidikan Terkini telah diumumkan oleh JSPS, dan cadangan serta permohonan pembiayaan oleh Toshio Yanagida sebagai Pengarah Pusat Biologi Kuantitatif Riken (QBiC) (juga, Dilantik Khas Profesor dan Profesor Emeritus Universiti Osaka; Pengarah Pusat Maklumat dan Rangkaian Neural) telah diluluskan pada tahun 2010 untuk persediaan untuk penubuhan Riken QBiC. Bajet ini diperuntukkan kepada Riken dan Universiti Osaka untuk aktiviti penyelidikan kerjasama mereka. Kami mencadangkan untuk menggunakan sebahagian daripada belanjawan untuk membangunkan cryoTEM peleraian tinggi yang mesra pengguna dan mendapatkan kelulusan untuk meminta JEOL membangunkannya. Kami menyampaikan idea, visi dan spesifikasi yang diperlukan kepada pasukan teknikal JEOL, dan mereka bersetuju untuk memulakan pembangunan. JEOL merancang untuk melengkapkan prototaip cryoTEM menjelang musim bunga 2014, dan kami mengadakan banyak perbincangan berulang kali sepanjang banyak mesyuarat. Nama panggilan yang kami buat untuk cryoTEM baharu ini ialah CryoARM, dan JEOL menamakannya CRYO ARM™ (Gamb. 2). Salah satu matlamat yang kami tetapkan adalah melebihi 2.0 Å sebagai resolusi yang boleh dicapai dalam analisis struktur kompleks biomolekul.
Walaupun pembangunan itu ditangguhkan kerana pelbagai keadaan dan sebab, prototaip cryoTEM akhirnya dipasang pada Mei 2016 di bangunan Nanobiologi. Mengikut pelan reka bentuk awal yang dibuat pada masa FEG Sejuk belum tersedia, prototaip CRYO ARM ini dipasang dengan FEG Terma dengan voltan pecutan 200 kV. Kami memeriksa cincin Thon dalam transformasi Fourier bagi imej filem nipis Pt/Ir yang direkodkan di bawah nyahfokus 1 μm dan mengesahkan bahawa cincin Thon melangkaui resolusi 1.8 Å (Rajah 4). Misi penting kami bermula dari titik ini. Kami menyediakan grid cryoEM bagi banyak spesimen biomolekul yang berbeza dan mengumpul imej cryoEM untuk menganalisis strukturnya dengan analisis imej zarah tunggal untuk menilai prestasi cryoTEM untuk resolusi. Kami juga meneliti dan menilai dengan teliti pelbagai aspek cryoTEM, seperti kemesraan pengguna operasi cryoTEM dan perisian kawalan, kepantasan dan kelancaran operasi manual dengan stesen kerja cryo untuk pemindahan grid cryoEM serta operasi autoloader, kecekapan pengumpulan data melalui rakaman imej automatik, dan perkara yang perlu diperbaiki dalam perisian pemerolehan data automatik JADAS ke arah pengumpulan data automatik sepenuhnya, untuk menyalurkannya kembali kepada jurutera JEOL. Seperti yang kami ramalkan, begitu banyak masalah mekanikal yang kerap berlaku dengan pemuat automatik dan stesen kerja cryo, dan jurutera JEOL terpaksa mereka bentuk semula sistem dan alat ganti, kadangkala dengan bahan baharu, dan membawanya dari Akishima, Tokyo, untuk digantikan dengan yang lama. dan membuat pelarasan penderia dan penggerak untuk menyelesaikan masalah tersebut. Ia hampir setiap minggu selama kira-kira setengah tahun dari pemasangan. Peringkat spesimen sebahagian besarnya direka bentuk semula untuk kestabilan yang lebih tinggi, dan perisian kawalan sistem TEM juga telah ditambah baik termasuk pengenalan butang satu klik pada paparan untuk mencapai pencahayaan selari dan penjajaran optik bebas koma. Kaedah cryoEM memegang dengan begitu banyak pengetahuan yang terkumpul sepanjang tahun pembangunannya, dan sistem cryoTEM boleh berfungsi dengan baik hanya dengan melaksanakan dan merealisasikan semua pengetahuan dan spesifikasi penting tersebut. Jurutera JEOL bekerja keras untuk menjadikan sistem cryoTEM ini berfungsi seperti yang kami inginkan. Pada bulan Februari 2017 apabila setiap fungsi prototaip CRYO ARM™ ini akhirnya mula berfungsi dengan stabil, dan kami tidak pernah mengalami sebarang masalah serius sejak itu.
Kami menggunakan β-galactosidase sebagai sampel ujian untuk melihat resolusi analisis struktur yang boleh dicapai dengan data imej yang dikumpul dengan CRYO ARM™. Kami juga meneruskan penilaian kami terhadap kestabilan operasi perkakasan dan perisian untuk penambahbaikan selanjutnya dan terutamanya tertumpu pada JADAS, program perisian pemerolehan data automatik yang JEOL telah bangunkan selama ini, untuk menjadikannya sesuatu yang boleh digunakan oleh setiap pengguna cryoEM dengan selesa. pengumpulan data yang cekap. JADAS boleh digunakan secara praktikal selepas beberapa kemas kini, dan pada musim panas 2017 kami dapat mengumpul 2,500 imej daripada grid cryoEM β-galactosidase selama 3 hari. Kami mengambil kira-kira 350,000 imej zarah tunggal daripada mereka, memilih kira-kira 88,000 imej yang baik dengan melalui klasifikasi 2D dan 3D mengikut
Adakah anda seorang profesional perubatan atau kakitangan yang terlibat dalam penjagaan perubatan?
Tidak
Sila diingatkan bahawa halaman ini tidak bertujuan untuk memberikan maklumat tentang produk kepada orang ramai.
